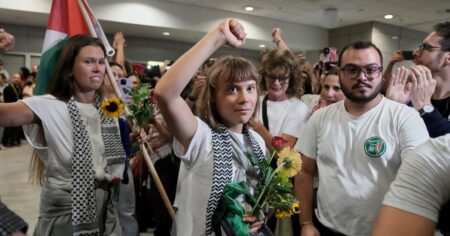Van tres años seguidos en que el Premio Nobel de Medicina va para científicos que trabajaron temas de inmunología. En 2023 y 2024, los galardones fueron por los hallazgos en materia de vacunas Covid y ARN mensajero. Y, esta semana, a los tres investigadores que explicaron la llamada tolerancia inmunitaria periférica, un mecanismo cuya falla o déficit se suele asociar a las enfermedades autoinmunes. Ahora bien, ¿por qué a esta altura del partido muchas autoinmunes tienen tratamiento y otras son mucho más difíciles de abordar?
En investigaciones paralelas que partieron de preguntas completamente distintas y a lo largo de más de 20 años, el japonés Shimon Sakaguchi y los estadounidenses Mary E. Brunkow y Fred Ramsdell, ahora laureados por la Academia Sueca, intentaron sistematizar y comprender las funciones de los distintos tipos linfocitos que componen el “ejército” defensor del sistema inmune humano.
Hay que aclarar que el espectro de enfermedades autoinmunes es tan complejo, que en general los expertos prefieren hablar de «tratamiento» y no de «cura», sea una autoinmune de las que afecta a un solo órgano del cuerpo, como de esas más caprichosas que alteran el organismo de manera sistémica.
En cualquier caso, la pregunta sigue siendo la del principio: si la ciencia llegó a comprender el mecanismo por el que el sistema inmune ataca agentes patógenos (infecciosos, cáncer…) sin matarnos a nosotros en el camino, y si la base de esas alteraciones es más o menos la misma, ¿por qué todavía hay patologías autoinmunes que no tienen un tratamiento efectivo?
O sea, por qué la psoriasis, la celiaquía o la diabetes tipo 1 son enfermedades que se abordan con cierto optimismo, pero no siempre ocurre lo mismo con la artritis reumatoide o el lupus eritematoso sistémico.
 El momento del anuncio de los tres ganadores del Nobel de Medicina 2025. Foto: AP
El momento del anuncio de los tres ganadores del Nobel de Medicina 2025. Foto: AP
Jorge Geffner es investigador Superior ad-honorem del Conicet y dirige tanto el Instituto de Investigaciones Biomédicas en Retrovirus y SIDA (INBIRS) como el Departamento de Microbiología de la Facultad de Medicina de la UBA, precisamente el área de la que depende la cátedra de Inmunología, su campo de expertise. En la charla con Clarín, el investigador dio a entender que todo es un problema de grises. O, más bien, de su falta.
Por qué hay enfermedades autoinmunes sin tratamiento
Geffner arrancó con una explicación que a muchos los retrotraerá a la pandemia, las vacunas Covid y al propio SARS-CoV-2: “Primero hay que entender qué es la respuesta inmune del organismo. Es la forma como enfrentamos los distintos desafíos del universo de microorganismos patógenos de naturaleza infecciosa, sean bacterias, hongos, parásitos o virus, más los desafíos de naturaleza no infecciosa, como los tumorales”.
Hay dos grandes “brazos” de esa inmunidad: la innata y la adaptativa, que es mucho más específica y dirigida contra ciertos patógenos. “La adaptativa reposa en dos grandes compartimentos, podríamos decir, que son los llamados linfocitos T y B”, sumó.
Para llegar al hallazgo de los Premios Nobel de Medicina 2025 y responder la pregunta inicial, hay que entender cómo sigue esta película: “Cuando vos nacés, traés un repertorio de millones de clones distintos de linfocitos B y T. Lo que diferencia a esos clones entre sí es su especficidad; es decir, contra qué van a reaccionar. Algunos lo harán contra el SARS-CoV-2, otros contra el VIH, y así”.
Buena parte del problema es la falta de grises comentada arriba, y es que, “para tener tantos clones distintos de linfocitos dirigidos a tantos blancos, uno paga un costo”, adelantó.
 Shimon Sakaguchi recibe un ramo de flores durante una conferencia de prensa en Osaka tras conocerse el Nobel. Foto: AP
Shimon Sakaguchi recibe un ramo de flores durante una conferencia de prensa en Osaka tras conocerse el Nobel. Foto: AP
El costo de la evolución inmunológica
Fue la propia evolución humana la que no pudo zafar (por ahora, al menos) de este costo, digamos, técnico. Consiste en que, para ser capaces de “pegarle” a tantos blancos ofensivos, alguno que otro nos termine autoinfringiendo.
Ese mecanismo, o sea la posibilidad de que haya clones de linfocitos que atenten contra nuestro cuerpo, es la base de las enfermedades autoinmunes. Algo así como la contracara de nuestra propia fortaleza. “La evolución no encontró otro camino”, sentenció Geffner.
Sin embargo, en la mayoría de los casos no nos morimos ni nos enfermamos atacados por nuestro sistema inmunológico, y esto es porque, afortunadamente, existe un mecanismo regulador. Este es el hallazgo de los Premio Nobel de Medicina de este año, lo que en el sector llaman tolerancia inmune periférica.
“No nos morimos porque existe esta subpoblación de células T reguladoras, que suprimen y regulan y también frenan la respuesta inmune cuando hay que hacerlo”, apuntó Geffner.
En criollo y para quien recuerde esas famosas tormentas de citoquinas que provocaban la internación de muchas personas con Covid (todavía no vacunadas), los linfocitos T reguladores ayudan a que el sistema inmune no se termine pasando de rosca.

En busca de una terapia para las autoinmunes
Es clave aclarar que el surtido de clones capaces de atacar distintos males (tumores, microorganismos infecciosos…) depende de un mecanismo aleatorio y, por lo tanto subjetivo. Por eso una persona expuesta igual que otra a los mismos microbios, puede resfriarse o no cada invierno, según su suceptibilidad (o sea, sus clones de linfocitos T). Esto, sin contar el aporte que hace el estilo de vida (“alimentación, actividad física, sueño”, enumeró Geffner), que también robustece todavía más los “soldaditos” de defensa personal.
Pero, si bien se sabe que el déficit o alguna disfuncionalidad en las células T reguladoras abre las compuertas para que el sistema inmune avance en contra nuestro bajo la forma de tal o cual enfermedad autoinmune, la parte terapéutica es menos llana.
Llegamos a la pregunta inicial. Y Geffner la respondió: “En primera instancia, conocer los signos o síntomas de cierta enfermedad autoinmune, no significa haber comprendido los mecanismos subyacentes a ella. Y de hecho, algunas patologías tienen distintos mecanismos subyacentes posibles detrás; un desafío médico a dilucidar por el médico tratante”.
Entonces, mientras una enfermedad como la psoriasis suele ser más “uniforme”, en el sentido de que tiende a depender de un factor en particular (una citoquina que en las terapias se busca bloquear), en afecciones como la artritis reumatoide o el lupus eritematoso sistémico, los mecanismos subyacentes que las provocan son variados y menos «lisos».
Mientras la ciencia básica no los haya delimitado acabadamente (“porque todo este hallazgo de los Nobel es ciencia básica”, reforzó Geffner), se seguirán eligiendo las terapias inmunosupresoras como tratamiento no ideal pero posible.
Es decir, la estrategia de inactivar todo ese surtido o repertorio de clones de linfocitos defensores, como si las alternativas fueran «tener toda la fuerza posible» o «no tener nada». La inmunosupresión tiene muchas veces su costado efectivo. Sin embargo, al no ser una terapia focalizada, involucra un costo para la salud general.
PS
Sobre la firma
 Irene Hartmann
Irene Hartmann
Redactora de la sección Sociedad [email protected]
Bio completa
Mirá también
Mirá también
Antisemitismo en Palermo: la víctima reveló un ataque previo y la familia del agresor tomó una decisión para evitar nuevos conflictos

Mirá también
Mirá también
Pagan US$ 127 millones por el mega terreno del Ejército en Palermo: qué planean construir

Newsletter Clarín
Recibí en tu email todas las noticias, coberturas, historias y análisis de la mano de nuestros periodistas especializados
QUIERO RECIBIRLO
Tags relacionados




 //
//